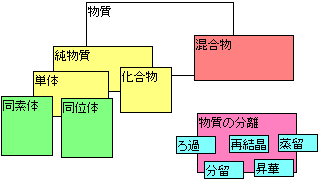

| 物質 | ┏ | 混合物 | ━ | ━━━ | ━ | 例(空気、岩石、海水、土、石油) |
| ┗ | 純物質 | ┳ | 単体 | ━ | 例(H2(水素)、O2(酸素)、Fe(鉄)、C(ダイヤモンドetc)) | |
| ┗ | 化合物 | ━ | 例(H2O(水)、CO2(二酸化炭素)、NaCl(塩化ナトリウム)) |
| 成分元素 | 同素体 |
|---|---|
| 酸素 | 酸素(O2)、オゾン(O3) |
| リン | 黄(おう)リン、赤(せき)リン |
| 硫黄 | 斜方硫黄、単斜硫黄、ゴム状硫黄 |
| 炭素 | 黒鉛、ダイヤモンド |
| 元素記号 | 11H | 21H | 31H | 126C | 136C | 146C | 168O | 178O | 188O | 3517Cl | 3717Cl |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 陽子数 | 1 | 1 | 1 | 6 | 6 | 6 | 8 | 8 | 8 | 17 | 17 |
| 中性子 | 0 | 1 | 2 | 6 | 7 | 8 | 8 | 9 | 10 | 18 | 20 |
| 電子数 | 1 | 1 | 1 | 6 | 6 | 6 | 8 | 8 | 8 | 17 | 17 |