
理科で初めて原子に勉強したとき、「水素原子はHと表されるが、通常は水素分子H2の状態で存在する。」 と教えられ、なぜそうなるのかと疑問に思ったことがあると思います。なぜ原子は単体では無く、複数の原子が 集まった状態で存在するのかと。身近にある磁石がお互いに力を及ぼしあうように、原子やイオンなどの粒子も お互いに力が働きます。
そもそもどうして原子やイオンなどの粒子間に力が働くのでしょうか。原子の構造をもう一度復習すると、 原子は正電荷(+)を持つ陽子と負電荷(-)を持つ電子から成っています。このような電荷の間に働くをクーロン力と言い、 これが粒子間に働く様々な力の源です。
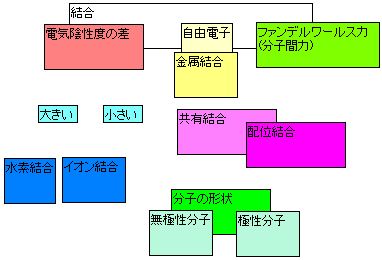
それでは原子や分子などの粒子の間にどのような力が働くのか挙げておきます。
分子中の原子間には電子を介した力が働き、これを共有結合と言います。
イオンは電荷を持っているので、お互いにクーロン力を受けます。
陽イオンと陰イオンの間には引力(いんりょく:引き合う力)が働き、その結合をイオン結合と言います。
銅(Cu)や鉄(Fe)といった金属の間には、自由電子を介した力が働きます。
そして分子間や原子間には弱い力ではありますが分子間力(ファンデルワールス力)と呼ばれる力が働きます。
ファンデルワールス力は3種類の異なる力があわさったものですが、 主な力は分散力と呼ばれます。 この力は極性、非極性にかかわらず どのような分子にも作用する力です。


イオン結合は陽性の強い原子(金属元素)と陰性の強い原子(非金属元素)の間に生じる結合です。 上の図ではNaCl(塩化ナトリウム)におけるイオン結合の形成を表しています。 一般的にイオン結合は金属元素と非金属元素の間に生じます。これは非金属元素と金属元素との 電気陰性度の差が大きいからです。 電気陰性度は上の図のようになっています。NaClだとNaの電気陰性度は0.9、Clの電気陰性度は 3.0となります。これだけ差が大きいと電子は電気陰性度の大きい原子の方に移ってしまいます。
またイオン結合の強さは、陽イオンと陰イオンの電荷の大きい方が強くなります。 イオン結合からできている物質には、NaClの他にCaCl2(塩化カルシウム)、MgO(酸化マグネシウム)、 CaO(酸化カルシウム)等があります。 なお、イオン結合しているいずれの原子も最外殻電子の数が8個(水素、リチウム等は2個)になっています。


共有結合は非金属元素間に生じることが多い結合です。例えば水素分子H2で見てみると 水素原子は最外殻電子が1つなので、後一つ電子があると安定になります。 そこで水素原子はそれぞれの電子を一つ出し合い、それを共有します。 そうすることで最外殻電子の数を安定な8(水素は2)にします。 このように二つの原子が電子を共有する結合を共有結合といいます。また共有結合した原子団を分子といいます。
例えばイオン結合しているNaCl(塩化ナトリウム)は分子ではありません。共有結合をしているものは、 HCl(塩化水素)、CH4(メタン)、CO(一酸化炭素)、SO2(二酸化硫黄)、 CH3OH(メタノール)等があります。塩化水素の形成も上図の右側に示しておきます。 上の図を見てもらえばわかりますが、共有された電子対は共有電子対と呼ばれます。 また、共有されていない電子対は非共有電子対と呼ばれ、電子対になっていない単独の電子は 不対電子と呼ばれます。
上ので示したように水素原子はお互いの電子を共有しています。このように1つの共有電子対による結合を 単結合といいます。また、CO2 (二酸化炭素)の炭素原子と酸素原子間のように2つの共有電子対に よる結合を二重結合といいます。これと同じように窒素分子中の窒素原子間にみられる3つの共有電子対に よる結合を三重結合といいます。
このとき、単結合を一本の線(これを価標という)で表し、分子中の原子の結合を示した式を構造式といいます。 この構造式は原子の結合を示している式で、分子の立体的な形状を表しているわけではありません。 また、下のように二重結合は二本線、三重結合は三本線で表します。
| 分子式 (名称) |
H2O(水) | CH4(メタン) | NH3(アンモニア) | CO2(二酸化炭素) | N2(窒素) |
| 電子式 |  |
 |
 |
 |
 |
| 構造式 |  |
 |
 |
 |
 |
| 分子の形状 |  |
 |
 |
 |
 |
| V字形 | 正四面体形 | 三角錐形 | 直線形 | 直線形 |
 |
+ | H+ | → |  |
 |
+ | H+ | → |  |
NH4+(アンモニウムイオン)はNH3(アンモニア分子)の非共有電子対を H+(水素イオン)と共有したものです。水素イオンは最外殻電子を2個にするために ちょうどアンモニア分子の非共有電子対が必要なのです。このようにして作られた結合を配位結合といいます。
NH4+中の配位結合はどれも同じで区別がつきません。 しかし、NH4+とNH3の同じN-H結合であっても結合の強さは同じではありません。
これと同じように水分子と水素イオンが配位結合するとH3O+(オキソニウムイオン)を生じます。
これを左図の下に示しています。
他にはSO42-(硫酸イオン)やNO3-(硝酸イオン)なども
配位結合が生じて作られていると考えられます。このように分子やイオンが、その非共有電子対を
ほかの水素イオンや金属イオンに与えると配位結合を生じることがあります。
水素分子や酸素分子のように一種類の原子から構成される分子は、2つの原子の電気陰性度が等しいので 電子は2つの原子に同じ力で引き寄せられており、電子は2つの原子の中間に位置しています。 だから電荷の偏りは生じていません。しかし、もし分子を構成する原子の電気陰性度が違ったらどのようになるでしょうか?
例えば、HCl(塩化水素)で考えてみると、水素の電気陰性度は2.1、塩素の電気陰性度は3.0となります。 電気陰性度は電子の引きつけやすさなので、電子は塩素の方に強く引きつけられます。 そうなると塩素の近くに電子が引き寄せられ、塩素には弱い負の電荷が生じます。 反対に水素は電子が離れ、弱い正の電荷が生じています。
このように電気陰性度に差のある原子が分子を構成している場合、電気陰性度の大きい原子に負の電荷が、 電気陰性度の小さい原子に正の電荷が生じています。 このような電荷の偏りがあることを極性があるといいます。 極性は原子間の電気陰性度の差が大きいほど大きくなります。 極性がある分子のことを極性分子といい、反対に極性のない分子のことを無極性分子といいます。
また分子の極性は原子間の電気陰性度の差だけでなく分子の形も影響しています。 下図中のΔ(デルタ)は「わずか」であることを示します。
| CO2(二酸化炭素) | NH3(アンモニア) | H2O(水) | CH4(メタン) | N2窒素 |
| 1.直線形 | 2.三角錐形 | 3.V字形 | 4.正四面体形 | 5.直線形 |
 |
 |
 |
 |
 |

固体の金属は、価電子を放出して陽イオンになっています。例えばナトリウムNaであれば、最外殻電子を放出します。 放出された電子は自由電子となり規則正しく配列している陽イオン間を自由に動き回り、 それぞれの陽イオンを結びつけています。このようにして金属原子を結びつけている結合を金属結合といいます。
この自由電子が金属の特徴をつくる要因となっています。 金属の特徴として、熱伝導性が良い。電気伝導性が良い。展性、延性がある。金属光沢がある。 融点が高いという点が挙げられます。このような金属の特徴の原因は自由電子にあります。
まず熱伝導性が良い理由を説明します。 物質というのは温度が高ければ高いほど、原子や分子などの粒子が激しく振動したり、移動したりしています。 例えば共有結合からなる酸素分子を高温にしたとします。このとき酸素分子の共有結合中の電子は自由に動けないので、 酸素分子が激しく運動することになります。一方で、金属を熱した場合、ある程度自由に動ける電子、つまり自由電子が あるので金属原子よりも自由電子が動き回ります。自由電子は原子よりもかなり軽いので、少しの熱でも 激しく運動し、金属中を移動します。このように金属が熱された場合、自由電子がその熱を受け取り動き回るので 金属は熱伝導性が良いと言えます。
電気伝導性についても同じような理由で、金属中には自由電子があるので、金属に電圧をかけると自由電子が動き、 それが電流となります。共有結合からなる物質では自由に動ける電子がないので、電圧をかけたとしても 電子が動けず、電流は流れません。このように自由電子の存在が、電気伝導性を良くすることにつながります。
次になぜ展性や延性があるのかを説明しようと思います。 例えばアンモニア分子を考えてみると、アンモニア分子の形は決まっています。共有結合分子というのは、電子が自由に 動けない分、分子の形が決まっています。その一方で、金属では自由電子は自由に動き回れるので、金属原子もある程度 動けます。そのため金属は箔にしたり、延ばしたりすることができます。
金属光沢を持つ原因も自由電子があるからと言えます。金属中の自由電子の密度が高いと、 光(=電磁波)が金属に入ってきたとき、その金属のプラズマ振動数以下の光では自由電子の振動により反射されます。 通常の金属ではプラズマ振動数が可視光線よりも高いところにあるので、可視光線が反射され金属光沢があるように 見えます。このように自由電子が金属の性質に深く関わっています。
最後にもう一つ金属の性質についてみておきましょう。通常、金属は温度が高くなるほど電気伝導率が悪くなります。 温度が高いということは、金属イオンも激しく振動しており、自由電子が移動するのを邪魔します。 だから金属は温度が高くなると、自由電子が動きにくくなり、電気伝導率が悪くなります。 反対に温度を下げると金属イオンの振動が弱くなり、自由電子は動けやすくなるので電気伝導率は良くなる傾向にあります。


水素結合という結合はとても重要な役割を果たしています。水素結合の影響を強く受けている物質は私達の 身近なものにもあります。それは水です。水の特異な性質、液体よりも固体の方が密度が低い。 分子量のわりに融点が高い。ものを溶かすなどの性質に水素結合が多く関わっています。
まずは水素結合が及ぼす影響をみていきましょう。 14族から17族の各元素の水素化合物の沸点を左図に示しています。 14族の水素化合物は周期が大きくなるにつれ沸点が高くなっているのがわかると思います。 14族の水素化合物は極性がなく分子の質量が順に大きくなるにつれ沸点が高くなります。
しかし、15〜17族元素では2周期の水素化合物の沸点が特に大きいです。
これは元素の電気陰性度の差が大きく影響しています。N、O、F、は特に電気陰性度が大きくN-H、O-H、F-H間の結合では
電子がN、O、Fの方に大きく引き寄せられます。したがって水素原子は正に電荷をおびます。
このため上図のように隣あった分子間で水素を介し、静電気的な引力が働きます。
このように電気陰性度の大きな原子の間に水素原子を介して生じる結合を水素結合といいます。