| L 1.0 | Be 1.5 | B 2.0 | C 2.5 | N 3.0 | O 3.5 | F 4.0 | ||||||||||
| Na 0.9 | Mg 1.2 | Al 1.5 | Si 1.8 | P 2.1 | S 2.5 | C 3.0 | ||||||||||
| K 0.8 | Ca 1.0 | Sc 1.3 | Ti 1.5 | V 1.6 | Cr 1.6 | Mn 1.5 | Fe 1.8 | Co 1.8 | Ni 1.8 | Cu 1.9 | Zn 1.6 | Ga 1.6 | Ge 1.8 | As 2.0 | Se 2.4 | Br 2.8 |
| Rb 0.8 | Sr 1.0 | Y 1.2 | Zr 1.4 | Nb 1.6 | Mo 1.8 | TC 1.9 | Ru 2.2 | Rh 2.2 | Pb 2.2 | Ag 1.9 | Cd 1.7 | In 1.7 | Sn 1.8 | Sb 1.9 | Te 2.1 | I 2.5 |
| Cs 0.7 | Ba 0.9 | La-Lu 1.1-1.2 | Hf 1.3 | Ta 1.5 | W 1.7 | Re 1.9 | Os 2.2 | Ir 2.2 | Pt 2.2 | Au 2.4 | Hg 1.9 | Tl 1.8 | Pb 1.8 | Bi 1.9 | Po 2.0 | At 2.2 |
| Fr 0.7 | Ra 0.9 | Ac 1.1 | Th 1.3 | Pa 1.5 | U 1.7 | Np-No 1.3 |
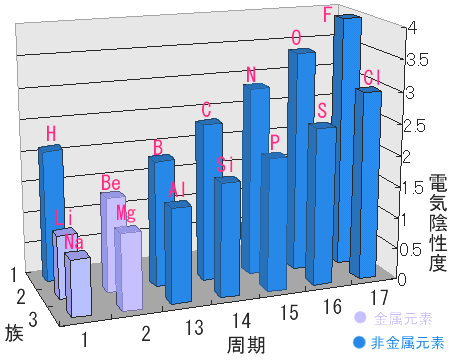
左の表は各原子の電気陰性度を示しています。陰性は左にいけばいくほど強くなると言いましたが、電気陰性度もそうなっているのがわかると思います。 ところどころで同周期で左より右の方が電気陰性度が小さい場合がありますが、遷移元素の場合電子配置が少し複雑なのでそうなる場合があります。 しかし、全体的に見れば左に行けば、下に行くほど電気陰性度は小さくなります。
原子同士の結合においてこの電気陰性度はとても大きな意味を持ちます。この値が大きいほど電子が引きつける力が大きいということは、もし電気陰性度に 差があると同じ共有結合でも、共有される電子がどちらかの原子の方に引きつけられて分子内で電荷の偏りを生じます。
また、電気陰性度の差が2以上の時にはその原子間の結合は完全なイオン結合であるとみなされます。 よって、電気陰性度の差が小さいほど、共有結合を生じ、大きいほどイオン結合を生じやすいといえます。 だから電気陰性度の大きい非金属元素同士の結合は共有結合で、電気陰性度の大きい非金属元素と金属元素との結合はイオン結合が多いのです。