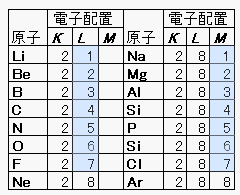
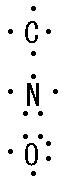 原子は最外殻電子の数により原子の安定さが変わります。各原子の最外殻電子は一番左図の色付き部分です。
左図にはありませんが、K殻が最外殻となり、その中に2個の電子が入っている原子をHe(ヘリウム)と言います。
K殻には2個まで電子が入れ、K殻に2個つまりK殻が満杯になると非常に安定になります。
だからHeは自分だけでいるのが最も安定で、他の物質と結びついたりしません。
ま、極低温などの条件が揃えばHeもヘリウム分子(He2)のようになる事もありますが、
これは特別な場合です。
原子は最外殻電子の数により原子の安定さが変わります。各原子の最外殻電子は一番左図の色付き部分です。
左図にはありませんが、K殻が最外殻となり、その中に2個の電子が入っている原子をHe(ヘリウム)と言います。
K殻には2個まで電子が入れ、K殻に2個つまりK殻が満杯になると非常に安定になります。
だからHeは自分だけでいるのが最も安定で、他の物質と結びついたりしません。
ま、極低温などの条件が揃えばHeもヘリウム分子(He2)のようになる事もありますが、
これは特別な場合です。
ドルトンの原子説では、「原子はそれ以上分割することのできない最小の粒子」とありますが、 原子は電子と原子核からできており、原子核は陽子と中性子からできており、これらはクォークと呼ばれる 素粒子から成っています。そのため原子を素粒子に分解する事もできるようです。 加速器を使って電子などを加速し原子にぶつけるなどの方法があります。 しかし、普通の化学反応では原子の結合の仕方が変わるだけで、 原子が新しくできたり、消滅したりすることはありません。
現在では金(Au)といったような原子は、その振る舞いまでも電子顕微鏡等で見ることができます。 しかし、水素(H)といった軽い元素は現在の技術を持ってしても見ることはできません。
電子は原子核の周りの、ある軌道上を回っています。 このページを見ているパソコンなどあらゆる電化製品を動かす電気、つまり電流の正体は電子です。 電子の質量は非常に小さく、陽子の質量を1とするとその1/1840しかありません。 大きさは・・・わからないようです。電子の大きさは無いと書いているものもあります。
また、電子は負の電荷を持っているので e- のように表されることもあります。 電気の正体は電子なので、電子の持っている電荷が一番小さいことになります。 電子の持っている電荷の大きさを素電荷や電気素量と呼んだりします。
電子は原子核の周りをまわっているというイメージですが、どこでも自由に存在できるわけではありません。 だからこそ電子殻という電子が存在することができる軌道が作られるのです。 ここでは何故電子殻が形成されるのか見てみましょう。 これは高校レベルの化学では必要のない知識ですが、 どうして電子殻なんて存在するのか納得のいかない人は見てみてください。 何故電子殻が形成されるのか非常に大雑把に説明しています。

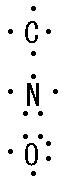 原子は最外殻電子の数により原子の安定さが変わります。各原子の最外殻電子は一番左図の色付き部分です。
左図にはありませんが、K殻が最外殻となり、その中に2個の電子が入っている原子をHe(ヘリウム)と言います。
K殻には2個まで電子が入れ、K殻に2個つまりK殻が満杯になると非常に安定になります。
だからHeは自分だけでいるのが最も安定で、他の物質と結びついたりしません。
ま、極低温などの条件が揃えばHeもヘリウム分子(He2)のようになる事もありますが、
これは特別な場合です。
原子は最外殻電子の数により原子の安定さが変わります。各原子の最外殻電子は一番左図の色付き部分です。
左図にはありませんが、K殻が最外殻となり、その中に2個の電子が入っている原子をHe(ヘリウム)と言います。
K殻には2個まで電子が入れ、K殻に2個つまりK殻が満杯になると非常に安定になります。
だからHeは自分だけでいるのが最も安定で、他の物質と結びついたりしません。
ま、極低温などの条件が揃えばHeもヘリウム分子(He2)のようになる事もありますが、
これは特別な場合です。
そのほかの電子殻では収容可能な電子数に関わらず最外殻電子が 8の時非常に安定になります。 一番左の図ではNe(ネオン)原子とAr(アルゴン)原子が非常に安定ということになります。 この8と言う数字は原子の結合や性質を考える上で重要になるので必ず覚えておきましょう。
また最外殻電子を特に価電子といいます。 価電子の数はLi(リチウム)は1、Be(ベリリウム)は2、B(ホウ素)は3です。 価電子数は図の色付き部分です。 ただしHe(ヘリウム)やAr(アルゴン)などの最外殻電子数が8の原子は価電子を0とします。 また、元素記号に最外殻電子を書き足したものを電子式と言います。 例えばC(炭素)、N(窒素{ちっそ})、O(酸素)はそれぞれ図のようになります。
ところで、K(カリウム)の最外殻電子はどうなっているのでしょうか?もちろん数は1個ですが、M殻がまだ 全部埋まってないのに電子がN殻に入っています。なぜでしょうか? 気になる人はここのページを見て下さい。
 陽子と中性子の質量はほとんど同じです。
数値で言うと陽子は1.673X10-27Kg、中性子は1.675X10-27Kgとなります。
ほんの少しだけ中性子の方が質量が大きいことが分かります。
陽子と中性子の質量はほとんど同じです。
数値で言うと陽子は1.673X10-27Kg、中性子は1.675X10-27Kgとなります。
ほんの少しだけ中性子の方が質量が大きいことが分かります。
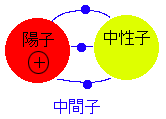
中性子は陽子同士が反発しないように糊の役目を果たします。 陽子と中性子は中間子と呼ばれるものをやりとりすることにより核力をもちお互いに引き合います。 このため原子核内に正電荷である陽子同士が多数存在できるのです。
また中性子は陽子+電子のように考えると質量が陽子より少し大きく、 電気的には中性であると考えられるのではないでしょうか。 そして陽子と中性子の質量はほんとど同じなので、陽子と中性子の数の和を質量数と言います。 これは原子の質量を比較するのに使います。
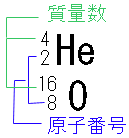 各原子にある陽子の数はそれぞれ決まっており、その数を原子番号としています。
例えば原子番号1の水素(H)なら陽子が1個、原子番号2のヘリウム(He)なら2個、
原子番号8の酸素(O)なら8個というふうに決まっています。
各原子にある陽子の数はそれぞれ決まっており、その数を原子番号としています。
例えば原子番号1の水素(H)なら陽子が1個、原子番号2のヘリウム(He)なら2個、
原子番号8の酸素(O)なら8個というふうに決まっています。
そして陽子だけだと、磁石のN極同士が反発するように、陽子だけでは反発しあって不安定なので、 中性子*注が入ることになります。 さらに陽子と中性子だけでは原子全体の電荷が+のままなので、陽子と電荷が反対である電子が 陽子の数と同じだけあります。こうして原子全体は電気的に中性となります。
先ほど質量数というのが出てきましたが左図のように元素記号の左上に表記します。
また多くの元素は同じ元素であっても質量数が異なるものがあります。
そのように原子番号は同じだが、
質量数の異なる原子を同位体といいます。