「イオウの同素体の観察」
(1)単斜イオウ、ゴム状イオウ(または無定形イオウ)、斜方イオウについて、
それぞれの性質(融点・沸点・水への溶解性・結晶形・電気伝導性など)を調べて
まとめなさい。
斜方硫黄、単斜硫黄の二つは性質が比較的よく似ています。
この二つは分子の形状も同じで、分子配列が多少異なり、その形状が、塊状(か
いじょう)か針状になっているかが違うだけです。
極性については05結合の種類の
下の方に分子の極性というのがあるので参考にしてください。
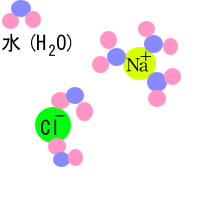 上のページを見れば、極性について多少なりともわかると思いますので、次に、塩(NaCl)が水に溶けた
時にどうなるかを左図に示してみました。右の図を見てもらえばわかるように陰イオンにほんの少しだけ正に帯電した水素が引きつけられ、
陽イオンにはほんの少しだけ負に帯電した酸素が引きつけられています。このように溶けた物質の周りに水分子が集まってきて、その
物質を包んでしまう・・・これが水に溶けると言うことなのです。もし、イオンにならない物質、例えばS8などが入ってきても
S8のまわりに水分子が集まってくることはなく、S8は水に溶けないのです。
上のページを見れば、極性について多少なりともわかると思いますので、次に、塩(NaCl)が水に溶けた
時にどうなるかを左図に示してみました。右の図を見てもらえばわかるように陰イオンにほんの少しだけ正に帯電した水素が引きつけられ、
陽イオンにはほんの少しだけ負に帯電した酸素が引きつけられています。このように溶けた物質の周りに水分子が集まってきて、その
物質を包んでしまう・・・これが水に溶けると言うことなのです。もし、イオンにならない物質、例えばS8などが入ってきても
S8のまわりに水分子が集まってくることはなく、S8は水に溶けないのです。
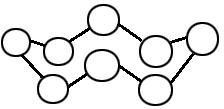 ここで、少し硫黄分子の話をしてみましょう。単斜硫黄、斜方硫黄はいずれも環状分子S8からなります。
それを左図に示しましょう。見てわかるように、硫黄分子は環状ですね。このタイプの分子がイオンになろうとすると・・・どこかの部分を切るぐらいし
ありませんね。化学の世界において不安定な方向に反応が進むことはないので、この硫黄原子の環(わ)が崩れることはないのです。だから、
このS8分子はイオン化しない、水に溶けないのです。
ここで、少し硫黄分子の話をしてみましょう。単斜硫黄、斜方硫黄はいずれも環状分子S8からなります。
それを左図に示しましょう。見てわかるように、硫黄分子は環状ですね。このタイプの分子がイオンになろうとすると・・・どこかの部分を切るぐらいし
ありませんね。化学の世界において不安定な方向に反応が進むことはないので、この硫黄原子の環(わ)が崩れることはないのです。だから、
このS8分子はイオン化しない、水に溶けないのです。
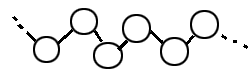 次に、ゴム状硫黄を構成する分子を見ていこう。それを左図に示した。左図を見てわかるように、
鎖状(さじょう)分子になっているのがわかると思います。くさりのように連なっているのを想像してください。ここで、いくつの分子から
この鎖状分子が構成されているかというと・・・それが一定ではないのです。つまり、いろいろな長さの硫黄分子が存在しているわけです。
単一の分子からできているのなら融点、沸点は同じとなります。しかし、ゴム状硫黄の場合、いくつもの硫黄分子からできているため、
沸点、融点共に一定になりません。
次に、ゴム状硫黄を構成する分子を見ていこう。それを左図に示した。左図を見てわかるように、
鎖状(さじょう)分子になっているのがわかると思います。くさりのように連なっているのを想像してください。ここで、いくつの分子から
この鎖状分子が構成されているかというと・・・それが一定ではないのです。つまり、いろいろな長さの硫黄分子が存在しているわけです。
単一の分子からできているのなら融点、沸点は同じとなります。しかし、ゴム状硫黄の場合、いくつもの硫黄分子からできているため、
沸点、融点共に一定になりません。
ここで、なぜ、分子の大きさが違うと、沸点や融点が違うのか考えてみよう。分子が大きくなると当然、質量が大きくなります。
そして、温度が上がるというのは物質の運動が激しくなるということです。もし、同じエネルギーが与えられたとき、質量が大きいと、
運動が激しくなりにくいですよね?重いのだから、動きにくいというわけです。
ところで、物質は固体の時は、原子や分子といった粒子が規則を持って配列されているので、結晶のような状態になっています。
この時に、熱(エネルギー)を与えられ融点を超えると、粒子はある程度自由に動けるようになり、規則的な配列にならなくなります。
この状態が液体です。さらに、熱(エネルギー)を与えられ沸点を超えると、粒子は好き勝手に動き回るようになります。
この状態が気体です。これが物質の変化の過程です。
ここでゴム状硫黄の話に戻ると・・・質量が大きくなると、動きにくいと言いましたね?同じエネルギーを与えられても、
S20はS16よりも重いために、運動が激しくなりにくいのです。そして、運動が激しくならないと、
温度も上がらないので、なかなか融点や沸点を超えられない・・・このように、物質の質量が違うと、融点や沸点が変わってくるのです。
このように、融点や沸点が違う物質が多数集まってできるゴム状硫黄の融点や沸点が一定にならないのは当然のことです。
電気伝導性ですが・・・電気が流れるとはどういうことか考えてみてください。金属であ
れば、自由電子の動きが電流となります。黒鉛(こくえん。教科書に必ず載っているので後ろの索引で探してみてください)の場合は3個の原子が、
同一平面上の他炭素原子との共有結合に使われ、もう一つは、自由電子のようにある程度、自由に動き回るこ
とができます。このため、電気伝導性が良くなります。ならば、この硫黄の場合はどうで
しょうか?
電気伝導性は・・・黒鉛の構造はわかりますか?黒鉛の構造と、
硫黄分子の形状を比較してもらえば、すぐにわかると思いますが。
自由になる電子が存在するかどうか、あるいは電子を放出したり受け取る
イオンの存在があるかどうか、このこのあたりから電気伝導性を推測してみてください。
結論をいうと、硫黄は電気伝導性はありません。電流の元になる自由電子や、イオンが発生しないからです。
単斜硫黄であれ、斜方硫黄であれ、ゴム状硫黄であれ、すべてそうです。
(2)イオウ以外の同素体の例を1つあげ、それらの性質上の違いについて調べま
とめなさい。
これについては、有名所ではやはりオゾンをやるのが無難ではないでしょうか?同素体については私のページでも少し触れています。
物質の分類です。ま、こちらは教科書程度にしかかいてません。
そしてオゾン(O3)はオゾン層に代表されるよう
に人間になくてはならないですよね?それに、オゾンは空気をきれいにする役目もありま
す。最近では、プールの水を洗浄するのに使われたりもします。
しかし、身近にオゾンが現れると・・・光化学スモッグの原因となったり、はたまた人体
に有害であったり・・・。これは酸素とは明らかに性質が違いますよね?この違いとなっ
ているのが酸化力です。この酸化力の差が生まれる原因が、分子の形状にあります。まぁ
〜酸素が3つあるのが安定かどうかを考えれば、このへんのことはすぐわかると思います
が。補足として、酸素と聞くと、酸化って思いますよね?オゾンはその酸素原子が三つから構成されています。
これ物質は不安定なので、すぐにO2-を他の物質に与える・・・すなわち、他の物質を酸化させてしまうのです。
中学の頃にこのような化学反応式を見たことはないですか?
Cu2++O2-=CuO
このようにオゾンは非常に酸化力が強いのです。これは正式な化学式ではないのですが、大体こういう感じだと思ってください。
(3)プラスアルファ、何か調べてまとめなさい。
というものなんですが・・・。
これについては・・・どうしようもありません。調べることがありすぎてねぇ・・・。
自分が、硫黄について最近調べたことを書いておけば、プラスアルファもいらない気もするんですけどねぇ。
ここまで深く考察してる人はいないですよ。って、私のミスでこうなったわけですが・・・。
以上、かなり簡単ですが終わります。わからないことがあれば、答えますが・・・
15日までには間に合わないです(T_T
一応、今日夜もネットに出ますが・・・それでは。
 上のページを見れば、極性について多少なりともわかると思いますので、次に、塩(NaCl)が水に溶けた
時にどうなるかを左図に示してみました。右の図を見てもらえばわかるように陰イオンにほんの少しだけ正に帯電した水素が引きつけられ、
陽イオンにはほんの少しだけ負に帯電した酸素が引きつけられています。このように溶けた物質の周りに水分子が集まってきて、その
物質を包んでしまう・・・これが水に溶けると言うことなのです。もし、イオンにならない物質、例えばS8などが入ってきても
S8のまわりに水分子が集まってくることはなく、S8は水に溶けないのです。
上のページを見れば、極性について多少なりともわかると思いますので、次に、塩(NaCl)が水に溶けた
時にどうなるかを左図に示してみました。右の図を見てもらえばわかるように陰イオンにほんの少しだけ正に帯電した水素が引きつけられ、
陽イオンにはほんの少しだけ負に帯電した酸素が引きつけられています。このように溶けた物質の周りに水分子が集まってきて、その
物質を包んでしまう・・・これが水に溶けると言うことなのです。もし、イオンにならない物質、例えばS8などが入ってきても
S8のまわりに水分子が集まってくることはなく、S8は水に溶けないのです。
 ここで、少し硫黄分子の話をしてみましょう。単斜硫黄、斜方硫黄はいずれも環状分子S8からなります。
それを左図に示しましょう。見てわかるように、硫黄分子は環状ですね。このタイプの分子がイオンになろうとすると・・・どこかの部分を切るぐらいし
ありませんね。化学の世界において不安定な方向に反応が進むことはないので、この硫黄原子の環(わ)が崩れることはないのです。だから、
このS8分子はイオン化しない、水に溶けないのです。
ここで、少し硫黄分子の話をしてみましょう。単斜硫黄、斜方硫黄はいずれも環状分子S8からなります。
それを左図に示しましょう。見てわかるように、硫黄分子は環状ですね。このタイプの分子がイオンになろうとすると・・・どこかの部分を切るぐらいし
ありませんね。化学の世界において不安定な方向に反応が進むことはないので、この硫黄原子の環(わ)が崩れることはないのです。だから、
このS8分子はイオン化しない、水に溶けないのです。
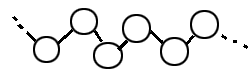 次に、ゴム状硫黄を構成する分子を見ていこう。それを左図に示した。左図を見てわかるように、
鎖状(さじょう)分子になっているのがわかると思います。くさりのように連なっているのを想像してください。ここで、いくつの分子から
この鎖状分子が構成されているかというと・・・それが一定ではないのです。つまり、いろいろな長さの硫黄分子が存在しているわけです。
単一の分子からできているのなら融点、沸点は同じとなります。しかし、ゴム状硫黄の場合、いくつもの硫黄分子からできているため、
沸点、融点共に一定になりません。
次に、ゴム状硫黄を構成する分子を見ていこう。それを左図に示した。左図を見てわかるように、
鎖状(さじょう)分子になっているのがわかると思います。くさりのように連なっているのを想像してください。ここで、いくつの分子から
この鎖状分子が構成されているかというと・・・それが一定ではないのです。つまり、いろいろな長さの硫黄分子が存在しているわけです。
単一の分子からできているのなら融点、沸点は同じとなります。しかし、ゴム状硫黄の場合、いくつもの硫黄分子からできているため、
沸点、融点共に一定になりません。