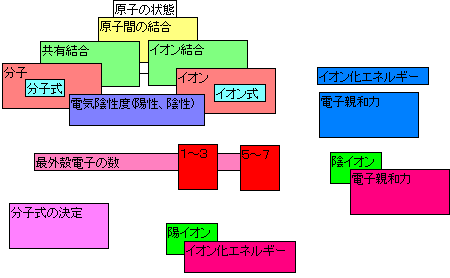

全ての物質は原子からできていますが、原子が単独で存在していることはあまりありません。 例えば、身近な水はどうでしょう。果たして水原子があるのでしょうか。実際には水原子というもはありません。 水は分子の状態で存在しています。水分子はH2Oと表され、 水素原子2個と酸素原子1個が結びついてできたものです。 水としての性質を表す最小の粒子はH2Oです。
このH2O(水)のような粒子を分子といいます。 例えばヘリウム分子はヘリウム原子1個から構成され単原子分子といいます。 また空気中に存在する酸素分子は酸素原子2個から構成され、O2と表され、 このような2個の原子からなる分子を二原子分子といいます。 原子が多い分子は多原子分子、デンプンやタンパク質等は高分子といわれます。
分子の書き方は分子を構成する原子を元素記号で示し、それぞれの原子の数を元素記号の 右下に書きます。 このような式を分子式といいます。 上記以外の分子を例にあげるとネオン分子はNe、 水素分子はH2、窒素分子はN2、アンモニア分子はNH3と書きます。 読み方は元素記号は英語で数字はそのまま読みます。水素分子なら「エイチにオー」、 アンモニア分子なら「エヌエイチさん」と読みます。 また分子の形はどのようになっているのでしょうか?下図に示してみました。

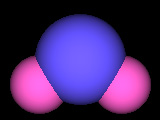
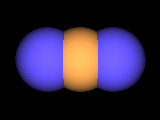
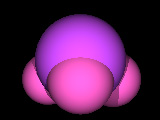

左から水素分子H2、水分子H2O、二酸化炭素CO2、アンモニアNH3
のモデル図です。これはあくまでイメージ図なので実際の分子がこのような形、色をしているわけではありません。
分子とは大体このような感じだと思ってくれれば良いと思います。
分子中のすべての原子は中性で共有結合により結合しています。
よって分子は共有結合によって結合した化合物です。
| 陽イオン | イオン式 | 陰イオン | イオン式 |
|---|---|---|---|
| 水素イオン | H+ | 塩化物イオン | Cl- |
| リチウムイオン | Li+ | ヨウ化物イオン | I- |
| ナトリウムイオン | Na+ | 水酸化物イオン | OH- |
| カリウムイオン | K+ | 硝酸イオン | NO3- |
| アンモニウムイオン | NH4+ | 過マンガン酸イオン | MnO4- |
| マグネシウムイオン | Mg2+ | 酸化物イオン | O2- |
| カルシウムイオン | Ca2+ | 硫化物イオン | S2- |
| バリウムイオン | Ba2+ | 炭酸イオン | CO32- |
| 亜鉛イオン | Zn2+ | 硫酸イオン | SO42- |
| 鉄(Ⅱ)イオン | Fe2+ | クロム酸イオン | CrO42- |
| 銅(Ⅱ)イオン | Cu2+ | ニクロム酸イオン | Cr2O72- |
| アルミニウムイオン | Al3+ | リン酸イオン | PO43- |
| 鉄(Ⅲ)イオン | Fe3+ |
先ほど分子の時は、原子は中性だといいましたが、電荷をもっているイオンという粒子もあります。 原子は周りに他の粒子が無い場合は電気的に中性で安定するのですが、周りに他の原子が来てその影響を 受けるとその原子と電子をやりとりして、電荷を持つようになることがあります。
このように周りの原子との間で電子のやりとりがある場合、 最外殻電子の数が8になると非常に安定になるので、最外殻電子の数を8にして安定になろうとします。 そして最外殻電子の数を8にするために電子を出したり取ったりします。
電子は負の電荷を持っているので、電子を奪い取った場合、原子は負の電荷を持ちます。 また、電子を奪われた場合、負の電荷である電子が少なくなったのだから原子は正の電荷を帯びます。 負の電荷を帯びた粒子を陰イオン、正の電荷を帯びた粒子を陽イオンといいます。 イオンは2個以上の元素から構成されることもあります。
また原子を陽イオンにする場合、原子核に引きつけられている電子を引き離すためにエネルギーが必要になります。 原子から電子を1個引き離し、1価の陽イオンにするのに必要な最小のエネルギーを第1 イオン化エネルギーといいます。 同様に、電子を2個引き離し、2価の陽イオンにするのに必要な最小のエネルギーを第2 イオン化エネルギーといいます。 イオンを表すにはイオン式を使います。そのイオンを構成する原子を元素記号で表し、原子の数を元素記号の右下に 書き、さらに右上に電荷を書き加えます。イオン式中の電荷の絶対値をイオンの価数といいます。 様々なイオンの例を左上に示してみました。
| H+(水素イオン) | Mg2+(マグネシウムイオン) | Fe3+(鉄(Ⅲ)イオン) |
| H-(水素化物イオン) | Cl-(塩化物イオン) | OH-(水酸化物イオン) | F-(フッ化物イオン) |
| NO3-(硝酸イオン) | SO32-(亜硫酸イオン) | CrO42-(クロム酸イオン) | CO32-(炭酸イオン) |
| NH4+(アンモニウムイオン) | H3O+(オキソニウムイオン) | |
| CH3COO-(酢酸イオン) | HCO3-(炭酸水素イオン) | HS-(硫化水素イオン) |
また上表と周期表を見比べてみましょう。 何か規則性が見つかると思います。一価の陽イオンになっているのは周期表の1族の元素です。 これと同じように2価の陽イオンになっているのはどこでしょうか? もちろん2族の元素です。また2族の元素以外にも 遷移元素が2価や3価の陽イオンになりやすい。 うまく表示されないかもしれません。その時は再読込をしてみて下さい。
なぜ1族の元素が1価の陽イオンになりやすいのでしょうか?それは1族の元素は最外殻電子の数がいづれも1個だからです。 最外殻電子の数が8個になると安定になるので1族の元素は1個の電子を放出して最外殻電子の数を8にしようとします。 だから負の電荷が一つ少なくなって、原子は正の電荷を帯び、陽イオンとなります。 しかし、1族の原子は陰イオンにはならないのでしょうか?答えはなりません。 最外殻電子の数を8にしようとするとあと7個も電子を取り込まなければなりません。 一個放出するのと7個取り込むのとではどちらがより簡単なのかはすぐに分かると思います。 2族の原子でも同じ事が言えます。イオンになったときのNa(ナトリウム)と酸素(O)の例を下図に示してみました。
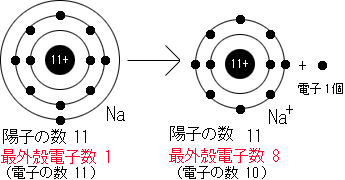
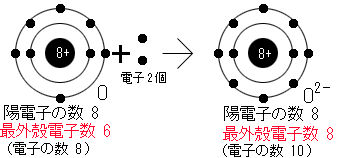
イオンは電荷を持っているので磁石がくっつくように陽イオンと陰イオンがお互いに 引き合いくっついてしまうことあります。代表的な物にはどこの家庭にもある塩(しお)です。 塩(しお)と言っても何種類もあるのですが、NaCl(塩化ナトリウム)が主成分です。 塩(しお)は一価の陽イオンであるNa+と一価の陰イオンであるCl-が、 お互いに一価どうしなので、1:1の割合で構成されています。 こうしてそれぞれのイオンの電荷が中和され、NaCl(塩化ナトリウム)は電気的に中性です。 しかし、NaClの固体中ではNaとClは共有結合していないのでNaCl分子としては存在していません。 下にNaClの模型を載せています。
NaClのような物質を構成する原子やイオンの数を、最も簡単な整数の比で表した式を組成式といいます。 これは分子式と似ていますが異なる式なので気をつけて下さい。分子式で示されている粒子はそれぞれの粒子が 共有結合で結ばれていますが、組成式で示されている粒子(イオン)は それぞれ静電気的な引力で引き合っています*。 またこのような結合をイオン結合と言います。 そして組成式や分子式などを総称して化学式と言います。
陽イオン | NH4+ アンモニウムイオン | Na+ ナトリウムイオン | Fe2+ 鉄(Ⅱ)イオン | Al3+ アルミニウムイオン |
|---|---|---|---|---|
| OH- 水酸化物イオン | NaOH 水酸化ナトリウム | Fe(OH)2 水酸化鉄(Ⅱ) | Al(OH)3 水酸化アルミニウム | |
| Cl- 塩化物イオン | NH4Cl 塩化アンモニウム | NaCl 塩化ナトリウム | FeCl2 塩化鉄(Ⅱ) | AlCl3 塩化アルミニウム |
| SO42- 硫酸イオン | (NH4)2SO4 硫酸アンモニウム | Na2SO4 硫酸ナトリウム | FeSO4 硫酸鉄(Ⅱ) | Al2(SO4)3 硫酸アルミニウム |
大体の組成式の作り方はまず陽イオンを先に書きその次に陰イオンを書きます。この時全体で電気的に中性にするためにイオンの価数に応じた割合で
それぞれのイオンの数を適するようにあわせます。つまり正の電荷の合計から負の電荷の合計を引いて0になるようにします。名称は陰イオンを先に、陽イオンを後にする。例えばNaHCO3では炭酸水素ナトリウムと 読みます。