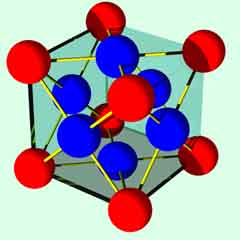
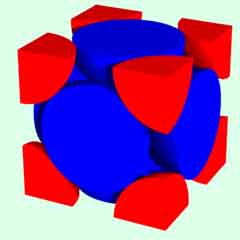
面心立方格子
配位数:12
配位数:12
| 1 8 |
x | 8 | + | 1 2 |
x | 6 | = | 4(個) |
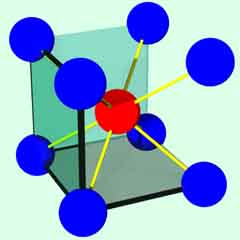
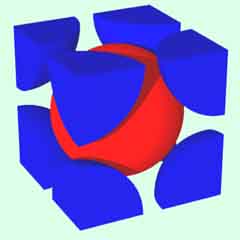
体心立方格子
配位数:8
配位数:8
| 1 8 |
x | 8 | + | 1 | = | 2(個) |
六方最密構造
配位数:12
配位数:12
| 1 12 |
x | 4 | + | 1 6 |
x | 4 | + | 1 | = | 2(個) |